Марина Поздеева о проявлениях, диагностике и фармакотерапии цистита
Хоть женщин и причисляют к слабому полу, организм у них сильный. Чего стоят тяготы вынашивания, рождения и вскармливания ребенка! Однако, к сожалению, особенности анатомии иногда обусловливают и приверженность женщин некоторым заболеваниям, в частности воспалительным процессам в мочевом пузыре, которые нередко приобретают хронический характер. О распространенной форме хронического интерстициального цистита — наша статья.
Под интерстициальным циститом (ИЦ) подразумевают клинический синдром, который характеризуется частым дневным и ночным мочеиспусканием и тазовой болью.
Цифры свидетельствуют о том, что в 90 % случаев патология приходится на женскую долю [1]. Раньше это заболевание считалось достаточно редким: предполагалось, что оно развивается всего лишь с вероятностью не более 5,1:1000 [2]. Однако в последние годы были получены менее обнадеживающие данные. Так, эпидемиологические исследования показали, что у американских женщин ИЦ выявляют с вероятностью 60–70:100000 [1]. В то же время в Европе распространенность заболевания не превышает 18 случаев на 100000 [3]. Столь ощутимая разница в эпидемиологических показателях Старого и Нового Света может объясняться как различиями в диагностических подходах, так и существенными расхождениями в образе жизни, питании и т. д. В РФ, к сожалению, не существует статистики распространенности ИЦ, и отечественные специалисты опираются, как правило, на информацию западных коллег.
Следует отметить, что ни семейное положение, ни количество сексуальных партнеров, ни уровень образования на вероятность развития ИЦ влияния не оказывают [1]. Средний возраст начала заболевания составляет 40 лет, однако не исключены случаи развития патологии и у молодых пациентов, в том числе и детей.
Как это ни печально, но этиология ИЦ до сих пор остается до конца не изученной. Определенную патогенетическую роль в развитии заболевания может играть недостаточность гликозаминогликанов в эпителиальном слое мочевого пузыря, что приводит к повышенной проницаемости прилежащих подслизистых тканей для токсичных веществ, содержащихся в моче [4].
Возможно, имеет значение инфекционный аспект, однако точно идентифицировать возбудителя заболевания и даже определенно оценить его роль в патогенезе ИЦ пока не удалось. Некоторые специалисты считают, что патология может быть связана с инфицированием каким‑либо еще неоткрытым медленно растущим вирусом или чрезвычайно прихотливой бактерией.
По другим данным, с ИЦ ассоциированы дисфункция мышц таза или нарушения мочеиспускания, а также аутоиммунные заболевания.
Раньше ученые исключали возможность передачи склонности к ИЦ по наследству, однако в 2005 году были получены результаты исследования, оценивающего возникновение заболевания у монозиготных и дизиготных близнецов. Они свидетельствуют, что для хронического интерстициального цистита характерна, по крайней мере, частичная генетическая предрасположенность [5].
Известно, что ИЦ часто протекает на фоне некоторых хронических заболеваний, в том числе воспалительных заболеваний кишечника, системной красной волчанки, синдрома раздраженного кишечника, фибромиалгии и атопической аллергии [1]. К тому же нередко ИЦ ассоциирован с психическими расстройствами, в частности депрессией.
К факторам риска, предрасполагающим к возникновению ИЦ, относятся:
- Пол. Как уже было сказано, в 90 % цистит наблюдается у женщин. Важно отметить, что у мужчин симптомы этого заболевания чаще всего связаны с сопутствующим простатитом.
- Цвет кожи и волос. Светлокожие рыжеволосые женщины подвержены более высокому риску развития ИЦ.
- Возраст. В большинстве случаев диагноз впервые устанавливается пациентам от 30 лет и старше.
- Хронический болевой синдром, например, синдром раздраженной толстой кишки или фибромиалгии.
Заболевание обычно начинается остро, когда пациент вдруг, в какой‑то определенный отрезок времени обнаруживает проблемы с мочеиспусканием. Нередко больные связывают начало симптомов ИЦ с инфекцией мочевыводящих путей.
Прежде всего, для патологии характерны частые и болезненные позывы к мочеиспусканию, которым сопутствует чувство давления, дискомфорта и боли в области таза, а также ощущение неполного опорожнения мочевого пузыря. Кроме того, появляются сексуальные расстройства, в том числе боль при половом акте, снижение либидо и частоты оргазма.
Хроническому циститу свойственны чередования периодов обострения и частичных или даже полных ремиссий, во время которых симптомы отсутствуют. Длительность острых периодов может значительно варьировать: от нескольких дней до месяцев или даже лет. В среднем через 8 месяцев после манифестации заболевания 50 % больных ждет спонтанная ремиссия различной протяженности [1]. У женщин симптомы интерстициального цистита иногда колеблются по степени выраженности в зависимости от фазы менструального цикла.
В отличие от инфекционных заболеваний мочевого тракта, интерстициальный цистит нельзя диагностировать с помощью привычного анализа мочи или ее посева. Факт наличия ИЦ подтверждается на основании характерной клинической картины, но только после исключения других возможных болезней, в том числе мочеполовых инфекций, мочекаменной болезни, рака мочевого пузыря, патологий почек, рассеянного склероза, эндометриоза и других [6]. Ключевой шаг диагностики ИЦ — цистоскопия — эндоскопическая диагностика мочевого пузыря с помощью уретроцистоскопа. В ходе процедуры в полость мочевого пузыря может вводиться жидкость с целью оценки функционального состояния органа.
В некоторых случаях во время цистоскопии проводят биопсию мочевого пузыря, позволяющую исключить злокачественные процессы и другие редкие причины болевого синдрома.
Терапия ИЦ имеет две главные задачи: купирование боли и уменьшение выраженности воспалительного процесса. К сожалению, достигнуть этих целей непросто. В большинстве случаев лечение интерстициального цистита у женщин и мужчин представляет серьезную проблему на пути восстановления нормального качества жизни пациентов. Не существует четко определенного, стандартного способа лечения, который бы позволил облегчить страдания большинства больных. Как правило, методика подбирается на основании индивидуального ответа пациента. При этом, учитывая вероятность спонтанной ремиссии, дорогостоящее или агрессивное лечение назначается с осторожностью [1].
Неотъемлемой частью терапии считается формирование у пациентов представления об, увы, хроническом течении заболевания, его прогнозе и сложностях с лечением. Важную роль в успешном контроле над ИЦ играет диетотерапия.
Некоторые исследования показали, что почти у 90 % пациентов обострение заболевания связано с приемом определенных продуктов. К перечню «опасных» продуктов относятся [1]:
- Кофе
- Алкоголь
- Глутамат натрия
- Томаты
- Уксус
- Цитрусовые
- Острая пища
- Шоколад
- Клюквенный сок
Многие специалисты рекомендуют или вовсе избегать потребления триггеров, или вносить их в рацион изредка. С целью отражения связи между введением в пищу различных продуктов и обострением симптомов ИЦ целесообразно вести дневник питания. Далее рассмотрим, как принято лечить интерстициальный цистит.
Наиболее частая ошибка в медикаментозной терапии ИЦ связана с некорректным назначением антибиотиков, абсолютно неэффективных в подобных случаях. Корни этого заблуждения лежат в изначально неверном диагнозе, которым, как правило, оказывается установленное эмпирически, на основании исключительно клинических симптомов, бактериальное воспаление мочевого пузыря. Можно сказать, залог эффективного лечения интерстициального цистита в правильном определении причин возникновения симптомов.
Медикаментозная терапия интерстициального цистита подразумевает назначение пероральных препаратов и внутрипузырных инстилляций лекарственных веществ.
Среди препаратов для внутреннего применения следует выделить:
- Трициклические антидепрессанты (амитриптилин). Назначенные в низких дозах препараты этой группы помогают расслабить мочевой пузырь, а также препятствуют высвобождению веществ, которые могут провоцировать болевой синдром и воспаление. К тому же трициклические антидепрессанты улучшают качество сна. По данным рандомизированного двойного слепого плацебоконтролируемого исследования, амитриптилин позволяет обеспечить статистически значимое улучшение состояния при ИЦ [7].
- Антигистаминные препараты, в частности гидроксизин, который в РФ относится к фармакологической группе анксиолитиков (транквилизаторов).
Противоаллергические средства блокируют высвобождение гистамина из тучных клеток, расположенных в стенках мочевого пузыря, что способствует уменьшению болевого синдрома, выраженности воспаления, а также снижению количества позывов к мочеиспусканию, в том числе и ночных. Следует учитывать, что гидроксизин может оказывать седативный эффект, поэтому его предпочитают назначать перед сном.
Для внутрипузырных инстилляций широко используется местное противовоспалительное средство диметилсульфоксид, это единственный препарат, одобренный для использования в этих целях Американским управлением за качеством пищевых продуктов и медикаментов FDA. На фоне введения диметилсульфоксида стенки мочевого пузыря расслабляются, уменьшаются боль и выраженность воспаления. Стандартный курс лечения включает шесть инстилляций (по одной в неделю на протяжении шести недель).
Кроме того, при ИЦ могут применяться физиотерапевтические процедуры (эндовезикальный ионофорез, лазерное фотооблучение мочевого пузыря, УВЧ, индуктотерапия, бальнеотерапия и др.), а также оперативное лечение, которое производится только в тяжелых упорных случаях. В ходе хирургического вмешательства пытаются добиться увеличения мочевого пузыря, оптимизации оттока мочи и проводят резекцию язвенных поражений слизистой (если они есть).
Несмотря на то что чаще всего заболевание имеет перемежающееся течение, которому свойственно чередование обострений и ремиссий, не исключены тяжелые случаи, при которых наблюдается постепенная и упорная прогрессия симптомов ИЦ, которую невозможно остановить. Иногда облегчить клиническую картину заболевания удается с помощью мер самоконтроля, таких как отказ от табакокурения, повышение физической активности, уменьшение влияния стрессовых факторов, подбор свободного нижнего белья и одежды и, конечно, соблюдение диеты.
Заболевание серьезно снижает качество жизни, причем настолько, что в США, например, этот диагноз дает основание для получения инвалидности. Работа, представленная американскими учеными под руководством Кимберли Хэпнер (Kimberly Hepner) в 2012 году, показала, что в группе взрослых женщин с симптомами ИЦ 11 % респонденток рассматривали самоубийство как способ освобождения от мучений, связанных с их болезнью [8]. Данные исследований свидетельствуют, что влияние ИЦ на качество жизни может быть сравнимо со страданиями, которые испытывают больные на терминальной стадии почечной недостаточности или ревматоидного артрита [9, 10].
Все эти малоутешительные сведения говорят, что перед современными учеными стоит непростая задача поиска новых средств и методов терапии хронического цистита — тяжелого заболевания, которое пока остается одной из сложных и пока еще неразгаданных загадок в мировой медицине.
- Rovner E. S., Kim E. D. Interstitial cystitis //Medscape Reference. May. — 2011.
- Konkle KS, Berry SH, Elliott MN, Hilton L, Suttorp MJ, Clauw DJ, et al. Comparison of an interstitial cystitis/bladder pain syndrome clinical cohort with symptomatic community women from the RAND Interstitial Cystitis Epidemiology study. J Urol. 2012 Feb. 187 (2):508–12.
- Curhan G. C., Speizer F. E., Hunter D. J. Epidemiology of interstitial cystitis: a population based study // The journal of urology. — 1999. — Vol. 161. — P. 549–552.
- Parsons CL, Boychuk D, Jones S, et al. Bladder surface glycosaminoglycans: an epithelial permeability barrier. J Urol. 1990 Jan. 143 (1):139–42.
- Warren JW, Keay SK, Meyers D, Xu J. Concordance of interstitial cystitis in monozygotic and dizygotic twin pairs. Urology. 2001 Jun. 57 (6 Suppl 1):22–5.
- Hsieh, CH; Chang, WC; Huang, MC; Su, TH; Li, YT; Chiang, HS (December 2012). «Treatment of interstitial cystitis in women». Taiwan Journal of Obstetrics & Gynecology. 51 (4): 526–532.
- van Ophoven A, Pokupic S, Heinecke A, Hertle L. A prospective, randomized, placebo controlled, double-blind study of amitriptyline for the treatment of interstitial cystitis. J Urol. 2004 Aug. 172 (2):533–6.
- Hepner, Kimberly A.; Watkins, Katherine E.; Elliott, Marc; Clemens, J. Quentin; Hilton, Lara; Berry, Sandra H. (June 2012). «Suicidal ideation among patients with bladder pain syndrome/interstitial cystitis». Urology. 80 (2): 280–285.
- American Urological Association Guideline: Diagnosis and Treatment of Interstitial Cystitis. Bladder Pain Syndrome [January 2011]» (PDF). American Urological Association. Retrieved 1 April 2011.
- Channing Laboratory, Department of Medicine, Brigham and Women’s Hospital, Harvard Medical School, Boston, Massachusetts, USA. Ho N, Koziol J, Parsons CL. Epidemiology of Interstitial Cystitis, in G. Sant (Ed.), Interstitial Cystitis. Philadelphia: Lippincott-Raven Publishers, 1997; 9–15.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
источник
Интерстициальный цистит (ИЦ) имеет неинфекционную этиологию и чаще всего диагностируется у женщин старше сорокалетнего рубежа. Опасность заключается в том, что на первых этапах заболевание может протекать практически бессимптомно, а затем дать о себе знать серьезными осложнениями.
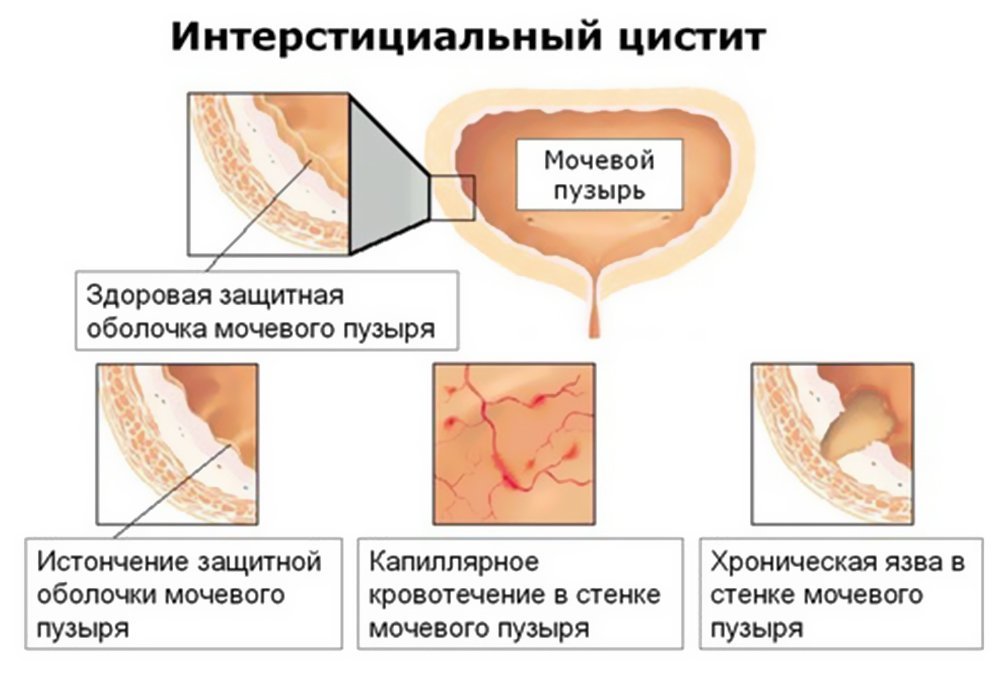
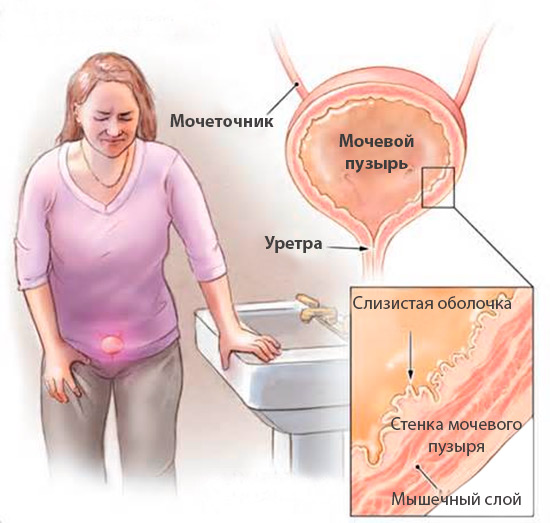
Интерстициальный цистит − синдром болезненного мочевого пузыря, на фоне которого возникает поражение тканей, расположенных под слизистой. Другое название болезни – язва Гуннера. Патология протекает в хронической форме и трудно поддается лечению. При отсутствии должной терапии процесс приводит к деформации мочевыделительного органа, который становится не способен полноценно выполнять свои жизнедеятельные функции.
Причины развития синдрома болезненного мочевого пузыря не установлены. Однако возникновению болезни могут способствовать такие провоцирующие факторы, как:
- аутоиммунная реакция;
- инфекции мочевыводящих путей;
- нарушение кровоснабжения;
- эндокринные нарушения;
- психосоматика;
- операция в области органов малого таза;
- увеличение чувствительности клеток к окислительному стрессу;
- дефицит гликозаминогликанов в эпителии слизистой оболочки.
Решающим фактором в развитии интерстициального цистита принято считать именно последний пункт. Гликозаминогликаны представляют собой полисахариды, которые являются составной частью межклеточных веществ соединительной ткани. При их недостатке слизистая органа становится более рыхлой, в результате чего моча контактирует с незащищенным слоем, вызывая его раздражение. По этой причине основная терапия направлена на устранение именного этого фактора.
Повлиять на развитие заболевания способны такие внутренние патологии, как астма, аллергия на медикаментозные препараты, ревматоидный артрит и спастический колит.
Интерстициальный цистит симптомы которого могут долго не проявляться или быть слабо выраженными, в период обострения проявляет себя следующим образом:
- болевой синдром в области малого таза;
- нарушение мочеиспускания;
- позывы в туалет более 10 раз в сутки;
- боль во время полового акта.
При хроническом болевом синдроме болезненные ощущения у женщин наблюдаются в области влагалища, которые могут отдавать в задний проход. При полном мочевом пузыре боль принимает более острую форму, которая постепенно стихает при опорожнении органа. Пациент испытывает частые позывы к микции, как в дневное, так и ночное время суток.
При половом контакте женщина испытывает дискомфортные и болевые ощущения (диспаурения).
Обострение синдрома болезненного мочевого пузыря может произойти при употреблении пищи, которое способствует раздражению стенок органа. К этой категории относятся кислые соки и фрукты (лимон), кофеиносодержащие напитки и продукты (кофе, чай, шоколад), алкоголь и т.д.
Интерстициальный цистит у женщин требует незамедлительного лечения, как только обнаружены его первые симптомы. При его отсутствии состояние грозит развитием следующих патологических процессов в мочевом пузыре:
- образование камней;
- деформация;
- атрофия;
- недержание мочи;
- кровоизлияния;
- заброс мочи в мочеточники.
Симптомы и лечение интерстициального цистита тесно взаимосвязаны. Именно исходя из симптоматики заболевания будет назначена соответствующая терапия. При постановке диагноза учитываются 3 важных критерия:
- продолжительность проявления симптомов;
- суточная частота позывов к микции;
- возраст пациента.
Следует исключить патологию, если характерные для нее симптомы беспокоят пациента менее 9 месяцев, частота позывов к мочеиспусканию меньше 10 раз в сутки, отсутствует микция в ночное время суток, возраст пациента менее 18 лет.
Диагностика хронического интерстициального цистита довольно сложная проблема. От специалиста потребуется применение клинических и вспомогательных методов исследований, а также аналитический подход к их результатам.
Диагностика интерстициального цистита требует тщательного сбора анамнеза. При этом должно быть учтены данные о состоянии половой сферы больной. С целью исключения вагинитов и уретрогименальных спаек проводится осмотр в зеркалах. Базовая диагностика также включает в себя:
- бакпосев мочи;
- анализ на чувствительность к антибиотикам;
- ультразвуковое исследование;
- забор вагинальных мазков с целью исключения ЗППП.
Обязательным этапом в диагностике заболевания является проведение цистоскопии, в ходе которой производится осмотр стенок мочевого пузыря. В 30 случаев из 100 у пациентов при интерстициальной форме наблюдается выраженное язвенное поражение органа.
После цистоскопии для исключения таких патологий, как рак или туберкулез мочевого пузыря, берется биопсия.
Интерстициальный цистит у женщин лечение которого требует в обязательном порядке комплексного подхода, включает в себя следующие терапевтически меры:
- прием медикаментов;
- проведение физиопроцедур;
- соблюдение диетотерапии;
- занятие ЛФК.
Интерстициальный цистит лечение которого должно быть в первую очередь направлено на восстановление слизистой, снятие болевого синдрома и блокирование воспалительного процесса, требует применения соответствующих препаратов.
Лечебные меры начинаются с проведения гидродистензии. Процедура заключается в ведении под давлением физиологического раствора в мочевой пузырь. После ее проведения наблюдается значительное улучшение в состоянии у большинства больных.
Следующие лечебные мероприятия связаны с введением в полость органа цитодеструктивных препаратов, к которым относятся диметилсульфоксид и нитрат серебра. Они способствуют разрушению клеток эпителиальной ткани, и стимулируют более быстрое их обновление. Дополнительно цитодеструктивные лекарственные средства обладают противовоспалительным эффектом. Курс включает в себя проведение 10 таких процедур.
Завершительным этапом выступает введение препаратов группы гликозаминоглюканов. К ним относятся Гепарин, гиалуроновая кислота, Гепон и Актовегин. Лекарственные средства этой категории оказывают иммуномодулирующий и противовоспалительный эффект. Они способствуют снятию болевых ощущений и ускоряют процесс восстановления слизистой оболочки.
Вышеперечисленные лечебные меры проводятся в условиях стационара.
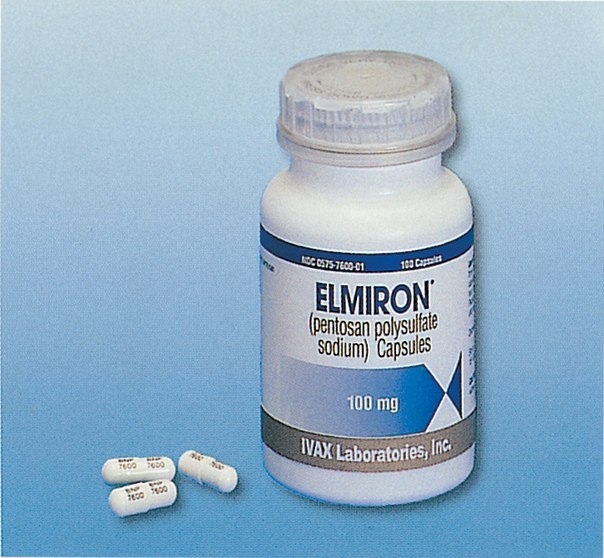
Для лечения в домашних условиях может быть назначен такой препарат, как Элмирон. Основным действующим веществом медикамента выступает пентозанполисульфат. Лекарственное средство относится к классу низкомолекулярных гепаринов. Препарат помогает ускорить регенерацию поврежденных тканей, и предотвращает дальнейшее раздражение стенок мочевого пузыря.
Дополнительно пациенту могут быть прописаны антигистаминные препараты (Гидроксизин), спазмолитики (Дриптан, Спазмекс), НВПС (Диклофенак) и антидеприссанты (Амитриптилин). Последняя группа препаратов прописывается с целью уменьшения нервозности, на фоне повышения которой может наблюдаться ухудшение состояния больного. Нормализовать работу нервной системы помогут и витамины группы В.
Для восстановления свойств соединительной ткани, пораженной в ходе патологического процесса, необходим также внутримышечное введение лонгидазы.
Хронический интерстициальный цистит в обязательном порядке лечится и с применением физиотерапии. Такой метод лечения помогает:
- снять воспаление;
- улучшить местное кровоснабжение;
- укрепить кровеносные сосуды;
- ускорить проникновение лекарств в слизистую;
- запустить процесс регенерации тканей.
В лечении интерстициального цистита важную роль занимает специальная диета. Заключается она прежде всего в полном устранении из рациона продуктов питания, которые способны раздражать слизистую мочевого пузыря. В список запрещенных продуктов и блюд включают:
При употреблении такой пищи ремиссия интерстициального цистита может мгновенно смениться периодом обострения.
Перед тем, как лечить интерстициальный цистит при помощи ЛФК, необходимо проконсультироваться со специалистом.
Наибольшую популярность среди видов лечебной физкультуры получила методика Кегеля. Комплекс упражнений был разработан американским урологом Арнольдом Кегеля с целью укрепления мышц тазового дна. Лечебная гимнастика также помогает улучшить местное кровообращение и иммунитет. Упражнения Кегеля сводятся к тренировки мышц промежности и заднего прохода путем их попеременного сжатия и расслабления.
Выполнять гимнастику рекомендовано не менее трех раз в день по 10-15 минут за один подход. Прежде чем приступить к занятию следует обратить внимание на несколько правил, включающие в себя:
- полное опорожнение мочевого пузыря;
- выполнение упражнений за час до приема пищи;
- расслабление мышц в период отдыха.
Во время гимнастики также нельзя задерживать дыхание и напрягать другие группы мышц.
В народной медицине интерстициальный цистит лечится при помощи отваров на основе толокнянки, ромашки, укропа, полевого хвоща, клюквы.
Напитки на растительной основе помогают уменьшить воспалительный процесс и способствовать более быстрой регенерации поврежденных тканей.
Операция показана пациентам при частичной и полной атрофии мочевого пузыря. Во время хирургического вмешательства проводится иссечение пораженной стенки и ее замена тканями кишечника. При полной атрофии орган удаляется целиком и замещается на новый, воссозданный при помощи собственной кишки пациента.
Так как не всегда удается выявить и устранить истинную причину развития патологии, предписанное лечение может оказываться не эффективным. Интерстициальный цистит требует от специалиста широкого кругозора, компетентности в области гинекологии, неврологии и иммунологии. При своевременно назначенной терапии и правильно проведенном лечении прогноз благоприятный. Излечить заболевание в большинстве случаев полностью не удастся, но можно снизить количество рецидивов.
источник
Медикаментозное лечение интерстициального цистита Текст научной статьи по специальности « Медицина и здравоохранение»
Аннотация научной статьи по медицине и здравоохранению, автор научной работы — Лоран О. Б., Синякова Л. А., Косова И. В.
Интерстициальный цистит (ИЦ) это клинический синдром, основными симптомами которого являются хроническая тазовая боль, учащенное болезненное мочеиспускание, императивные позывы, никтурия при наличии стерильного посева мочи. В большинстве случаев, при отсутствии характерной для этого заболевания Гуннеровской язвы, это диагноз исключения.
Похожие темы научных работ по медицине и здравоохранению , автор научной работы — Лоран О.Б., Синякова Л.А., Косова И.В.,
О.БЛОРАН, д.м.н., профессор, член-корр. РАМН, Л.А.СИНЯКОВА, д.м.н., профессор, И.В.КОСОВА, к.м.н., РМАПО, Москва
Медикаментозное лечение интерстициального цистита
Интерстициальный цистит (ИЦ) — это клинический синдром, основными симптомами которого являются хроническая тазовая боль, учащенное болезненное мочеиспускание, императивные позывы, никтурия при наличии стерильного посева мочи. В большинстве случаев, при отсутствии характерной для этого заболевания Гуннеровской язвы, это диагноз исключения.
■ Нарушения мочеиспускания, боли в области малого таза при ИЦ приводят к социальной дезадаптации больных.
Учитывая трудность и неоднозначность диагностических критериев, проведение эпидемиологических исследований крайне затруднено. В Финляндии в 1975 г., по данным Oravisto, заболеваемость ИЦ у женщин составила 18,1 случаев на 100 000, суммарная заболеваемость мужчин и женщин — 10,6 на 100 000. В 10% случаев ИЦ характеризовался тяжелым течением [1]. В 1989 г. в США провели популяционное исследование, в ходе которого было выявлено 43500 больных с подтвержденным диагнозом ИЦ. В 1990 г. Held выявил 36,6 случаев заболеваемости ИЦ на 100 000 [2]. В 1995 г. в Нидерландах выявлено от 8 до 16 случаев на 100 000 [3]. Вместе с тем данные о распространенности ИЦ в нашей стране отсутствуют [4].
Нарушения мочеиспускания, боли в области малого таза, учащенное мочеиспускание (до 100 раз в сутки без наличия инконтиненции) — эти симптомы сохраняются и в ночное время, что приводит к социальной дезадаптации больных: 60% больных избегают сексуальных отношений, количество самоубийств у этих пациентов в 2 раза выше, чем в популяции [5].
Интерстициальный цистит является одной из причин хронической тазовой боли у женщин [6] и хронического абактериального простатита или простатодинии у мужчин.
В настоящее время принята многофакторная теория изменений стенки мочевого пузыря у больных ИЦ, которые включают в себя изменения поверхности уротелия (GAG) и экстрацеллюлярного матрикса, увеличение проницаемости уротелия, влияние тучных клеток и изменение афферентной иннервации стенки мочевого пузыря (нейроиммун-ный механизм).
Основные этапы диагностики ИЦ включают: анализ жалоб пациента (в т.ч. с использованием раз-
личных видов опросников) и данных осмотра, проведение цистоскопии, уродинамических исследований, исключение других заболеваний нижних мочевых путей, протекающих со сходной клинической симптоматикой [7].
В 1987 г. в National Institute of Arthritis, Diabetes, Digestive and Kidney Diseases (NIDDK) были разработаны основные критерии диагностики ИЦ (табл. 1) [8].
Установить диагноз ИЦ достаточно сложно в связи с интермиттирующим и прогрессивным нарастанием симптоматики, а также с неспецифичностью симптомов, которые могут быть обусловлены и другими гинекологическими и урологическими заболеваниями [9]. Характеристика симптомов представлена в таблице 2.
К факторам риска развития ИЦ относятся: гинекологические, акушерские, хирургические вмешательства, спастический колит, синдром раздраженной толстой кишки, ревматоидный артрит, астма, аллергические реакции на медикаменты, аутоиммунные и некоторые другие заболевания.
Таким образом, несмотря на многообразие теорий развития ИЦ: нарушение проницаемости клеток уротелия, аутоиммунных механизмов, генетическая предрасположенность, нейрогенные и гормональные факторы или воздействие токсических агентов — этиология и патогенез заболевания остаются неизвестными. В связи с этим лечение данной категории больных — сложная задача. Из множества препаратов, применяемых для лечения ИЦ, ни один не имеет 100% эффективности.
По механизму действия основные виды неоперативного лечения ИЦ могут быть разделены на три категории [4]:
1. Лекарства, которые прямо или косвенно изменяют нервную функцию: наркотические или ненаркотические анальгетики, антидепрессанты, антигиста-минные, противовоспалительные, антихолинерги-ческие средства, спазмолитики.
Таблица 1. Критерии NIH/NIDDK диагностики интерстициального цистита 1
Критерии исключения Позитивные факторы Критерии включения
Возраст i Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
2. Цистодеструктивные методики, разрушающие зонтичные клетки мочевого пузыря и приводящие к ремиссии после их регенерации. К этим видам лечения относятся гидробужирование мочевого пузыря, инстилляции диметилсульфоксида, хлорпактина, нитрата серебра.
3. Цитопротективные методики, защищающие и восстанавливающие слой муцина в мочевом пузыре. К этим препаратам относятся полисахариды — такие как гепарин, пентозан полисульфат (PPS) и гиа-луроновая кислота.
Препараты, используемые для медикаментозной терапии, с учетом уровня доказательности (приложение 1), представлены в таблице 3.
Гистамин — это вещество, которое высвобождается тучными клетками и индуцирует развитие боли, вазодилатации и гиперемии. Принято считать, что инфильтрация тучными клетками и их актива-
ция является одним из многочисленных звеньев патогенеза развития ИЦ [10,11]. Эта теория и послужила обоснованием применения антигистаминных препаратов в лечении ИЦ.
Гидроксизин — это антагонист трициклического пиперазингистаминового 1 рецептора. Theoharides T.C. и соавт. впервые указали на эффективность его применения в дозе 25—75 мг в день у 37 из 40 больных ИЦ [12]. В другом исследовании была указана эффективность применения этого препарата ежедневно в течение 3 мес. примерно у 40% больных [13]. Исследование Interstital Cystitis Clinical Trials Group показало с высокой степенью доказательности неэффективность монотерапии
■ ИЦ является одной из причин хронической тазовой боли у женщин и хронического абактериально-го простатита у мужчин.
Таблица 2. Характеристика основных симптомов интерстициального цистита [4]
Симптомы « 5 лет, в % 5-10 лет, в % 10-15 лет, в % « 15 лет, в %
Императивные позывы 91,2 92,8 96,0 99,2
Поллакиурия 84,0 93,6 94,4 96,2
Тазовая боль 67,2 73,6 77,6 80,8
Давление над лоном 57,6 58,4 60,0 74,4
Спазмы мочевого пузыря 51,2 56,8 60,8 78,4
Жжение в мочевом пузыре 53,6 55,2 64,8 69,6
Боли при coitus 70,4 68,0 68,8 54,4
Боли, нарушающие сон 44,8 57,6 55,2 59,2
Число мочеиспусканий в сутки 19,4 26,8 49,6 88,9
Интервал между микциями днем, ч 1,2 0,9 0,5 0,3
Hydroxyzine в лечении больных ИЦ. В исследование были включены 121 пациентки, которые получали плацебо, гидроксизин, PPS или сочетание гидрокси-зина с PPS. Эффективность применения препарата по сравнению с плацебо составила 31 и 20% соответственно [14]. Отсутствие рандомизированных исследований с включением как минимум 1000 больных не позволяет с достоверной убежденностью доказать, что препарат неэффективен, и в то же время редукция симптомов менее чем у 50% больных указывает на минимальную эффективность препарата.
Циметидин — гистамин-2 антагонист. Клиническая эффективность препарата (400 мг х 2 раза в сутки) была доказана в двойном слепом рандомизированном плацебо-контролируемом проспективном исследовании у 34 больных с неязвенной формой ИЦ [15]. Получено достоверное снижение симптоматики в группе пациентов, получавших лечение (с 19,7 до 11,3), по сравнению с плацебо (19,4 до 18,7). Боль над лоном и никтурия оказались симптомами, по которым у большинства больных наступила регрессия.
Следует отметить, что при повторной биопсии до и после лечения антигистаминными препаратами изменений слизистой мочевого пузыря выявлено не было, поэтому механизм эффективности этих препаратов остается неясным [16].
Амитриптилин (элавил, эндеп) — трицикличес-кий антидепрессант, оказывает влияние на центральную и периферическую антихолинергическую активность, обладает антигистаминовым, седатив-ным эффектом, ингибирует обратный захват серо-тонина и норэпинефрина.
В 1989 г. Hanno et al. впервые указали на эффективность амитриптилина у больных с наличием болей над лоном и частым мочеиспусканием [17]. В настоящее время безопасность и эффективность применения препарата в течение 4 мес. в дозе 25—100 мг доказана в двойном слепом рандомизированном
плацебо-контролируемом проспективном исследовании. В исследование были включены 5 групп больных, при этом снижение симптоматики с 26,9 до 18,5 баллов наблюдалось у больных, получавших препарат, и с 27,6 до 24,1 — в группе плацебо (р=0,005). Боль и ургентность значительно снизились в лечебной группе, емкость мочевого пузыря увеличилась незначительно, но в группе у больных, получавших препарат, больше по сравнению с плацебо [18]. Через 19 мес. после окончания лечения сохранялся хороший ответ на применение препарата [19]. Амитриптилин обладает выраженным аналь-гезирующим эффектом в рекомендуемой дозировке 75 мг (25 мг до 100 мг). Эта доза ниже, чем та, которая применяется при лечении депрессии (150—300 мг). Регресс симптоматики развивается достаточно быстро: от 1 до 7 дней после начала приема препарата. Применение дозы более 100 мг ассоциировано с риском развития внезапной коронарной смерти [20].
L-аргинин — субстрат для окислительных процессов, существовало мнение, что применение этого препарата приведет к улучшению симптомов ИЦ. Оксид азота усиливает релаксацию гладкой мускулатуры, в связи с чем было выявлено снижение окислительных процессов у больных с ИЦ. Были проведены два двойных слепых рандомизированных пла-цебо-контролируемых проспективных исследования использования L-аргинина в дозе от 1,5 г до 2,4 г ежедневно в течение 3 мес. и плацебо [21, 22]. При этом не было выявлено достоверных различий в симптоматике в лечебной и контрольной группах, поэтому применение препарата в лечении больных с ИЦ не рекомендовано.
Пентозанполисульфат (эльмирон) PPS — это синтетический мукополисахарид, который выпускается в форме для перорального приема, его действие заключается в коррекции дефектов глюкозами-ногликанового слоя. Применяется в дозе 100 мг в день. Было проведено 6 двойных слепых плацебо-
Таблица 3. Препараты, используемые для терапии ИЦ,
по уровню доказательности, эффективности [7]
Препарат Уровень доказательности Рекомендации Рекомендации: использовать (+) /не использовать (-)
Амитриптилин 1 (эффективен) В (+)
Пентозанполисульфат Противоречивые данные, рекомендаций нет ф)
Гидроксизин 1 (особой эффективности не выявлено) В (-)
L-аргинин 1 (особой эффективности не выявлено) А (-)
контролируемых исследований эффективности PPS в лечении ИЦ. Parsons и Muholland [24] провели лечение пентозанполисульфатом 62 больных с ИЦ в дозе 300—400 мг в течение более 4 мес. и получили улучшение симптоматики у более 50% пациентов. Эти же авторы провели повторное исследование: применяли препарат в дозе 300 мг в течение 3 мес., при этом улучшение симптоматики наблюдалось только у 28% пациентов, получавших препарат и у 13% — плацебо [25]. Авторы третьего исследования (применение препарата в дозе 300 мг в течение 3 мес.) указывают, что эльмирон улучшает симптоматику, связанную с болью, ургентностью, учащенным мочеиспусканием, но не влияет на никтурию [26]. Позже Nickel и соавт., применяя различные дозировки препарата, доказали, что увеличение дозировки не приводит к более значимому улучшению качества жизни больного, но определенное значение имеет длительность применения [27]. В сравнительном исследовании PPS, гидроксизина и плацебо авторы получили менее обнадеживающие данные: 34% в группе пентозансульфата по сравнению с 18% в группе плацебо. Наилучшие результаты были получены при применении обоих препаратов в сочетании — 40% [14].
Несмотря на ряд проведенных исследований, высокую степень доказательности имеет исследование Holm-Bentzen (1987), при котором не было зарегистрировано статистически значимых отличий в эффективности исследуемого препарата и плацебо [28].
Побочные эффекты применения PPS в дозе 100 мг 3 раза в день встречаются достаточно редко и составляют менее 4% [29], проявляются чаще всего в виде обратимой алопеции, диареи, тошноты и сыпи. Очень редко встречаются кровотечения [30]. Учитывая, что препарат усиливает пролиферацию клеток рака молочной железы MCF-7 in vitro, его следует с осторожностью назначать пациенткам с высоким риском развития рака груди и женщинам в преме-
нопаузальном возрасте [31]. Таким образом, данные использования аналогов мукополисахаридного слоя весьма противоречивы, применение препарата находится в группе D, поэтому необходимы рандомизированные исследования высокой степени доказательности.
К другим препаратам для перорального приема, когда-либо использованных в лечении ИЦ, относятся: нифедипин, мизопростол, метотрексат, монтелу-каст, преднизолон, циклоспорин А. Однако их эффективность статистически не доказана, т.к. группы пациентов были относительно невелики (от 9 до 37 больных) 38.
Суммарные данные об эффективности внутри-пузырной терапии представлены в таблице 4.
Эффективность гидробужирования при ИЦ была описана ранее, его действие основывалось на ише-мическом некрозе нервных сенсорных окончаний в стенке мочевого пузыря, увеличении уровня гепарин-связанного фактора роста и изменении микро-васкуляризации [41, 42].
Наибольшая группа пациентов (65 больных) перенесла гидробужирование у Glemain и соавт. [43]. Бужирование проводилось под эпидуральной анестезией в течение 3 ч с небольшими перерывами. Эффективность метода при ретроспективном анализе составила 37,7% через 6 мес., 21,9% — через 1 год. При проспективной части исследования эффективность составила 60% через 6 мес. и 43,3% — через 1 год. Результаты гидробужирования у пациентов с первоначальной емкостью мочевого пузыря более 150 мл были лучше. Уровень доказательности метода 4, С.
Действие диметилсульфоксида (ДМСО) основано на повышении мембранной проницаемости, усилении абсорбции лекарственного препарата, противовоспалительном и анальгезирующем действии, способствовали диссолюции коллагена, расслабле-
Таблица 4. Препараты, используемые для внутрипузырной
терапии ИЦ по уровню доказательности, эффективности [7]
Препарат Уровень доказательности Рекомендации зовать (+) /не ис-
Диметилсульфоксид (ДМСО) 1 В (+)
Гепарин (как монотерапия после проведенного лечения ДМСО) 4, 1 С, В (+), (+)
Резиниферотоксин 1 (не эффективна) В (-)
нии мышечной стенки, выбросу гистамина тучными клетками.
Было проведено 3 исследования, при которых выявлено уменьшение симптоматики у 50—70% больных при использовании ДМСО в 50% концентрации [44]. Sant [45] наблюдал 22 пациента, у 40% больных после проведения 4 курсов терапии имел место рецидив. Perez-Marrero и соавт. [46] в плацебо-контролируемом исследовании подтвердили эффективность внутрипузырного введения ДМСО у 33 больных (93%) по сравнению с плацебо (35%). Данные подтверждены уродинамическими исследованиями, опросниками, дневниками мочеиспусканий. Однако после проведения 4 курсов терапии частота рецидива симптомов составила 59%.
Для снижения риска рецидива эти же авторы [47] провели работу, в которой часть пациентов получали внутрипузырно гепарин в дозе 10000 ЕД каждый месяц после курса ДМСО, а другая группа получала только ДМСО. Таким образом, авторам удалось добиться снижения процента рецидивов до 20% случаев в группе пациентов, получавших гепарин, по сравнению с 52% в группе монотерапии ДМСО. Уровень доказательности 1В (см. ниже), уровень реко-мендательности В.
Учитывая, что повреждение глюкозаминоглика-нового слоя является одним из факторов развития ИЦ, гепарин применятся как структура, являющаяся
аналогом мукополисахаридного слоя [48]. Кроме того, гепарин обладает противовоспалительным эффектом, ингибирует ангиогенез и пролиферацию фибробластов и гладкой мускулатуры. Parsons [49] и соавт. указывают на эффективность введения 10000 ЕД гепарина 3 раза в неделю в течение 3 мес. У 56% больных ремиссия сохранялась в течение 6 мес. Авторы делают вывод о том, что более чем у 50% больных ремиссия сохранялась до 1 года. Другие авторы получили сходные результаты [50].
Как было указано выше, применение гепарина после курса внутрипузырного введения ДМСО является эффективным методом лечения. Уровень доказательности 1В, уровень рекомендательности С.
Хорошие результаты были получены при применении внутрипузырного введения гепарина с гидрокортизоном в сочетании с оксибутинином и толтеродином. Эффективность метода составила 73% [51]. Монотерапия гепарином менее эффективна, уровень доказательности 4, уровень рекоменда-тельности С.
Патогенетическое обоснование применения ВЦЖ включает иммунную дисрегуляцию с возможным развитием дисбаланса между Th1 и Th2. Внутри-пузырное введение БЦЖ является методом иммунотерапии поверхностного рака мочевого пузыря.
Peters и соавт. провели рандомизированное проспективное исследование у 30 больных, которым
Таблица 5. Препараты, используемые для мультимодальной внутрипузырной терапии ИЦ по уровню доказательности, эффективности[7]
Препарат Механизм действия N Период наблюдения (мес.) Результаты Уровень доказательности Рекомендации: использовать (+), не использовать (-)
Доксепин 75 мг + пироксикам 40 мг Oral, C [71] Антидепрессант+ противовоспалительное 37 3 26 — ремиссия, 6 — улучшение » 80%, релапс симптомов после прекращения приема 4 открытое исследование С (+)
PPS + гидроксизин Oral, C [14] Протектор глюкозаминогликанового слоя + антигистаминный препарат 121 18 Эффективность метода 40%, NS 5 RCT D (-)
DMSO + гепарин (внутрипузырно) [47] Повышение проникновения гепарина в стенку 50 12 20% релапс при введении DMSO + Heparin по сравнению с 52% только DMSO 1 кет в (+)
Гепарин (внутрипузырно) + нейро-модуляция [72] Повышение проникновения гепарина в стенку, нейромодуляция воздействует на рефлексы мочеиспускания 10 13 Значительное улучшение по шкале симптомов, увеличение максимальной функциональной емкости мочевого пузыря 4 открытое исследование с (+)
Метилпреднизо-лон+ DMSO + гепарин (внутрипузырно) [73] Иммуномодулятор + нейро-модулятор, протектор глюкозаминогликанового слоя 25 12 У 23 ремиссия симптомов, в среднем в течение 8,1 мес. 4 открытое исследование с (+)
Примечание. Исследование: Ns — клинически не значимо, С — продолжается, RCT — рандомизированное, контролируемое.
еженедельно проводились инсталляции БЦЖ или плацебо в течение 6 нед. Среднее время наблюдения составило 8 мес. Эффективность использования БЦЖ-терапии составила 60% по сравнению с плацебо — 27%, однако разница статистически недостоверна. Наибольшее время наблюдения составило 27 мес., при этом у 89% больных из числа положительно ответивших на терапию сохранялась стойкая ремиссия [52].
Peeker и соавт. [53] провели проспективное двойное слепое сравнительное исследование БЦЖ и ДМСО. Ни у одного из 21 пациента не было улучшения максимальной функциональной емкости. Количество мочеиспусканий уменьшилось после введения ДМСО, но только у пациентов с неязвенной формой, чего не было отмечено после введения БЦЖ. Боль уменьшилась у пациентов как с язвенной, так и с неязвенной формой, но только после введения ДМСО.
В исследовании ICCTG продемонстрированы результаты мультицентрового рандомизированного двойного слепого плацебо-контролируемого исследования внутрипузырного введения БЦЖ для лечения рефрактерного интерстициального цистита [54], в которое были включены 265 пациентов. Положительный ответ на введение БЦЖ составил 21%, на введение плацебо — 12%. Тем не менее разница статистически недостоверна. Это крупное исследование указывает, что применять БЦЖ в лечении ин-терстициального цистита с умеренной и выраженной симптоматикой нецелесообразно.
Несмотря на то что Peters и соавт. [52,55] указывают на эффективность БЦЖ-терапии, данные его статически недостоверны (уровень доказательности 5). И наоборот, авторы ICCTG с высокой степенью достоверности указывают на неэффективность применения внутрипузырного введения БЦЖ (уровень доказательности 1Б) [7].
Гиалуроновая кислота — компонент глюкозами-ногликанового слоя, который находится в высоких концентрациях в субэпителиальном слое стенки мочевого пузыря и предназначен для защиты стенки мочевого пузыря от раздражающих компонентов мочи. Кроме того, гиалуроновая кислота связывает свободные радикалы и выступает в качестве имму-номодулятора.
Morales и соавт. [56] исследовали эффективность внутрипузырного введения гиалуроновой кислоты 1 раз в неделю в дозе 40 мг в течение 4 нед. Улучшение определялось как снижение выраженности симптомов более чем на 50%. Эффективность использования возросла с 56% после 4 нед. введения до 71% после 12 нед. Эффект сохранялся в течение 20 нед. Признаков токсичности препарата выявлено не было.
Nordling [57,58] предпринял проспективное нерандомизированное исследование эффективности
гиалуроновой кислоты с последующим 3-летним наблюдением у 20 больных с ИЦ. Лечение проводилось 1 раз в неделю в дозе 40 мг гиалуроновой кислоты в течение 1, 2, и 3 мес. После окончания этого этапа 11 пациентам было продолжено лечение. У 7 из них курс был продолжен до 37 мес., при этом признаков рецидива выявлено не было. Уровень доказательности 4, С.
Sodium oxychlorosene (хлорпактин) — дериват гипохлорной кислоты, действие которого обусловлено ее окисляющими свойствами. Введение препарата проводится под общим обезболиванием, т.к. внутрипузырная инстилляция болезненна. Наличие пузырно-мочеточникового рефлюкса является противопоказанием из-за высокого риска развития фиброза мочеточника. Необходимо также защищать зону промежности и интроитуса от контакта с хлор-пактином.
Messing и Stamey [59] провели лечение 52 больным путем введения 0,4% р-ра хлорпактина под давлением 10 см водного столба с перерывом 1 мес. Эффективность метода (улучшение симптоматики в течение более 6 мес.) составила 72%. Sant и LaRock [60] доложили о 50—60% улучшении симптоматики у 60 пациентов.
Необходимо помнить о том, что при недавно проведенных исследованиях в биопсийном материале стенки мочевого пузыря больных ИЦ не было выявлено бактериальных и вирусных агентов [61]. Уровень доказательности 4, С.
Резиниферотоксин (RTX) — это ванелоидный нейротоксин. Препарат может быть эффективен при лечении больных ИЦ за счет повреждающего воздействия на С-волокна мочевого пузыря, которые переносят болевой стимул и приводят к развитию учащенного мочеиспускания и ургентности. Lazzi-ri и соавт. [62] опубликовали пилотное исследование применения RTX у 5 больных с хорошими результатами. Payne и соавт. провели мультицентровое рандомизированное плацебо-кон-тролируемое исследование для определения эффективности и безопасности однократного введения препарата при лечения больных ИЦ [63]. В отличие от Lazzeri, при этом исследовании не было выявлено различий между лечебными группами (10, 50 и 100 мг RTX) по сравнению с плацебо. Кроме того, было указано на появление дозозависимой болезненности в области мочевого пузыря при инстилляции RTX, что подтверждено другими авторами [64]. Первый уровень доказательности указывает на неэффективность однократного внутрипузырного введения RTX.
■ Из множества препаратов, применяемых для лечения ИЦ, ни один не имеет 100% эффективности.
Ботулинический токсин (BTA) ингибирует выброс ацетилхолина в пресинаптических нейромус-кулярных соединениях [65]. Известен также антино-цицептивный эффект ВТА [66]. Schurсh и соавт. [67] впервые продемонстрировали эффективность и безопасность инъекций ВТА для лечения нейроген-ной инконтиненции. Smith и соавт. впервые описали внутридетрузорную инъекцию ВТА для лечения больных ИЦ [68]. Из 30 больных у 9 наступило улучшение симптоматики в первую неделю после применения препарата в дозе 100—200 ЕД. Симптоматика улучшилась на 71%. Согласно заполненным опросникам VAS, количество дневных мочеиспусканий, никтурия и боли уменьшились на 44, 45 и 79% соответственно. Позыв к мочеиспусканию и максимальная цис-тометрическая емкость увеличились на 58 и 57% соответственно.
И наоборот, Rackley и соавт. указывают на отсутствие изменений клинической симптоматики при введении ботулотоксина [69]. Таким образом, применение ВТА в лечении ИЦ может быть рекомендо-
■ Одна из гипотез, касающихся развития ИЦ, заключается в повреждении глюкозаминоглика-нового слоя и диффузии повреждающих агентов в стенку мочевого пузыря [23].
вано только после проведения контролируемых клинических исследований.
В последнее время внутрипузырное применение оксибутинина в дозе 10 мг показало свою эффективность, однако требуется проведение дальнейших исследований [70].
Учитывая многофакторную этиологию развития ИЦ, ряд авторов предлагают применять мультимо-дальную терапию, рассчитывая на синергизм эффектов и лучшие клинические результаты. Данные представлены в таблице 5.
Таким образом, несмотря на многообразие препаратов, применяемых в лечении ИЦ, ни один из них не является полностью эффективным. Необходимо проведение многоцентровых рандомизированных плацебо-контролируемых исследований для решения вопроса о целесообразности использования того или иного метода лечения. В 1969 г. Hanash и Pool так высказались об ИЦ: «. причина неизвестна, диагноз труден, а лечение паллиативное, эффект непродолжителен».
Приложение 1. Уровни доказательности и степени рекомендаций
Рейтинговая система подразделения клинических исследований и вытекающих из них выводов на несколько групп. Уровней доказательности исследования может быть несколько (от 3 до 5—7. Ниже только 3 категории), их обозначают латинскими цифрами, чем меньше цифра, тем большую достоверность имеют данные исследования.
— К категории I относятся хорошо разработанные, крупные, рандомизированные, контролируемые исследования, данные мета-анализов или систематических обозрений.
— К категории II относятся когортные исследования и исследования типа случай-контроль.
— К категории III принято относить неконтролируемые исследования и консенсусы специалистов.
Практические рекомендации по диагностике и лечению опираются как на данные исследований, так и на экстраполяции этих данных. С учетом этого обстоятельства рекомендации подразделяются на 3—5 уровней. Ниже только 4 уровня, которые принято обозначать латинскими буквами — А, В, С, D.
Рекомендации уровня А базируются на результатах исследований, относимых к I категории доказательности, и отличаются наиболее высоким уровнем достоверности.
Достоверность рекомендаций уровня В также довольно высока — при их формулировании используются материалы исследований II категории или экстраполяции исследований I категории доказательности. Рекомендации уровня С строятся на основании неконтролируемых исследований и консенсусов специалистов (III категории доказательности) или содержат экстраполяции рекомендаций I и II категории. К рекомендациям уровня D относят одну или более публикаций, основанных на 5 уровне доказательности или противоречивых данных, подтвержденных в исследованиях, соответствующих уровням доказательности от 1 до 4.
УРОВЕНЬ / ТЕРАПИЯ / ПРОФИЛАКТИКА, ЭТИОЛОГИЯ / РИСК
1 а — Систематические Обзоры (мета-анализ), Рандомизированные Контролируемые Клинические Испытания(РКИ)
1 Ь — Отдельные РКИ (с узким Доверительным Интервалом, низкий альфа-и бета-риск), обычно более 20 больных/1 группу
1с — РКИ с более высоким альфа- и бета-риском, обычно менее 20 больных/1 группа
2а — Высокого качества когортные проспективные исследования, Систематические Обзоры Когортных Исследований (серии, когорты из одного исследовательского центра с предложенной тактикой)
2Ь — Отдельные Когортные испытания высокого качества
За — Высококачественные ретроспективные исследования Случай-контроль, включающих группы пациентов, рандомизированных по полу, возрасту и т.д., страдающих одним и тем же заболеванием, и контрольную группы из общей популяции.
ЗЬ — Отдельные высококачественные ретроспективные исследования Случай-контроль, или когортные исследования низшего уровня, где когорты подобраны в разное время и из разных исследовательских центров.
4 — Высококачественные исследования, где группы пациентов с одинаковыми заболеваниями, получавших одинаковое лечение, изучались без контрольной группы. Или исследования более низкого уровня, где общей и контрольной группам проведено лечение в разное время или в разных центрах.
5 — Мнение экспертов, основанное не на доказательствах, а на личном опыте без точной критической оценки.
источник