Отек лица после облучения
Все побочные эффекты лучевой терапии можно подразделить на острые и хронические. Их возникновение зависит от общей дозы облучения, однократной дозы облучения, предыдущего или сопутствующего лечения (хирургического вмешательства и/или химиотерапии), объема опухоли.
Одним из главных факторов, ограничивающих дозу лучевой терапии, является мукозит. Выраженный лучевой мукозит может стать причиной перерывов в лечении с последующим рецидивом опухолевого роста. Если иммунная система больного подорвана химиотерапией, слизистые оболочки могут инфицироваться. Наиболее распространенным хроническим побочным эффектом является ксеростомия.
С целью повышения вероятности успеха лучевой терапии пациент должен отказаться от курения (курение повышает сопротивляемость опухолевых клеток облучению), тщательно следовать схеме лечения, избегая перерывов более чем на пять дней, активно искать поддерживающей терапии. Перед началом лечения пациента должен обследовать фониатр/специалист по глотанию, диетолог, специалист по контролю боли и психолог.
Все они могут помочь пациенту справиться с острыми и хроническими побочными эффектами лучевой терапии. Также перед началом лучевой терапии пациента должен осмотреть стоматолог, необходимо выполнить ортопантомограмму, при необходимости удалить больные зубы, приобрести фторированные каппы для зубов, которые могут быть полезны у больных с пломбами (наличие пломб ведет к более выраженному мукозиту, т. к. ионизирующее облучение рассеивается при встрече с пломбировочным материалом).
а) Острые побочные эффекты лучевой терапии головы и шеи. Побочные эффекты обычно появляются на третьей неделе лечения. Развивается дерматит, снижается секреция слизи, появляются охриплость, боли в горле, дисфагия, утомляемость, нарушения вкуса, ксеростомия. В редких случаях на первой неделе может развиваться паротит (вследствие закупорки выводных протоков железы густой слизью).
Ближе ко второй половине курса, когда симптомы усиливаются, у пациентов появляется необходимость в использовании кремов и масел для кожи, муколитиков, наркотических анальгетиков, противорвотных препаратов, изменений в диете (переход на жидкую пищу и жидкие питательные смеси). Пациентам, которые не способны перенести весь курс лечения (особенно в сочетании с химиотерапией), может быть наложена гастростома.
Пациенты могут сильно терять в весе, у них нарушается заживление ран. Все это ведет к сложностям с завершением курса лечения. Важно минимизировать любые перерывы в лечении, поскольку подавление роста опухоли нарушается при прерывании лечения на пять дней и более.
б) Хронические побочные эффекты лучевой терапии головы и шеи. Полное восстановление после курса лучевой терапии занимает несколько недель или месяцев. Отказаться от приема дополнительных препаратов пациенты обычно могут спустя 4-6 недель после окончания лечения. Наиболее тяжелыми хроническими побочными эффектами являются фиброз мягких тканей шеи и жевательной мускулатуры, выпадение волос, хондронекроз, дисфагия, гипотиреоз, ксеростомия.
Избежать образования стриктур верхнего сфинктера пищевода и фиброза мышц, участвующих в глотании, можно при раннем начале специальных глотательных упражнений. Невозможность нормального глотания может вести к хронической аспирации и необходимости постоянного использования назогастрального зонда. Для предотвращения распада зубов и остеорадионекроза пациенты должны тщательно соблюдать гигиену полости рта, избегать удаления или имплантации зубов.
в) Направление будущих исследований. В рандомизированном исследовании RTOG-H5022 будет оценена эффективность добавления С225 к курсу химиолучевой терапии (ускоренный курс облучения с двумя курсами цисплатина).
С учетом того, что у пациентов с раком ротоглотки, ассоциированным с ВПЧ, удается достичь превосходных результатов при использовании традиционных методов лечения, многие лечебные учреждения и исследовательские группы занимаются поиском наименее агрессивного варианта. Аналогичных результатов можно достичь использованием меньших доз облучения и меньшим количеством курсов химиотерапии, снизив при этом общую токсичность.
У пациентов с крайне агрессивными опухолями, которым требуется более радикальное лечение, возможно применение нескольких подходов: использование индукционной химиотерапии, эскалация дозы облучения, подключение брахитерапии или биологической терапии.
С другой стороны, ведется поиск радиопротективных препаратов, которые помогут предотвратить развитие мукозита и других побочных эффектов и одновременно с этим увеличить вероятность сохранения функции пораженного органа, поскольку целью лечения является не только подавление опухолевого роста, но и поддержание общего качества жизни на достойном уровне.
Например, исследуется возможность использования лучевой терапии с модулированной интенсивностью (ЛТМИ) для снижения риска развития дисфагии и снижения дозы химиолучевой терапии. Это позволит сохранить пациентам глотание и устранит необходимость в использовании назогастрального зонда.
С целью дальнейшей персонализации лечения разрабатываются новые методы лучевой диагностики и молекулярной диагностики, с помощью которых, как мы надеемся, удастся найти сбалансированный способ излечения с использованием минимально допустимых доз и косметическими и функциональными результатами лечения.
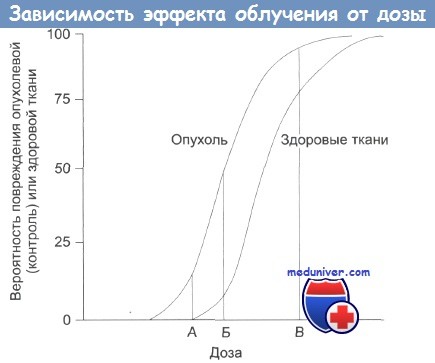
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
г) Ключевые моменты лучевой терапии:
• В основе лучевой терапии лежит нарушение способности опухолевых клеток к делению. Ионизирующее излучение вызывает формирование свободных радикалов, которые разрывают двухспиральную цепь ДНК.
• Здоровые ткани обладают большей репаративной активностью, чем опухолевые, поэтому они более устойчивы к действию ионизирующего излучения. Именно эта разница в репаративных свойствах нормальных и опухолевых тканей и позволяет убивать злокачественные клетки, сохраняя целостность и функциональность окружающих тканей.
• Как правило, для избирательной терапии используется доза в 50 Гр (грэй), для лечения остаточных микроскопических опухолей — 60 Гр, для лечения крупных новообразований — 70 Гр.
• В случае плоскоклеточного рака головы и шеи время и частота использования лучевых методов лечения имеют особое значение, т.к. данные опухоли способны к отложенной ускоренной репопуляции на фоне проводимой лучевой терапии. Феномен репопуляции во время терапии и способность раковых клеток к дифференциальной репарации часто обусловливает необходимость использования различных фракционных режимов подачи ионизирующего излучения.
Улучшить результаты лечения можно сокращением общего курса терапии и эскалацией дозы с гиперфракционированием.
источник
Отек после лучевой терапии. Может это лучевой фиброз?
Регистрация: 05.08.2007 Сообщений: 0 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Отек после лучевой терапии. Может это лучевой фиброз?
У мужа было две операции по поводу рака гортани. После всего диагноз следующий:умереннодифференцированный плоскоклеточный рак с ороговением. Удалена гортань,трахея, шейная часть пищевода и лимфоузлы на шее справа. После второй операции- расширенная лимфоаденоктомия справа- назначена лучевая терапия. Прошли 15 сеансов по 2,4гр. Были болезненные ощущения, покраснения кожи. Но по окончании луч.терапии начался сильный отек лица. Предположительно фиброз. К своему лечащему врачу обратиться не можем(в отпуске). Может кто-нибудь сталкивался с подобными последствиями облучения? Спасибо.
Регистрация: 14.04.2007 Сообщений: 657 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Вопрос специалистам лучше задать в раздел Радиотерапия http://www.oncoforum.ru/forumdisplay.php?f=31024
Или дать ссылку на свою тему модераторам раздела В.В. Барышеву и Филимонову А.В. в раздел форума «Nota Bene!» http://www.oncoforum.ru/forumdisplay.php?f=32511
Возможно, для ответа будет недостаточно информации — через какое время после окончания курса начался отёк, сколько продолжается, кто и на основании каких данных предположил фиброз?
Регистрация: 05.08.2007 Сообщений: 0 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Спасибо за консультацию, но я написала в раздел Радиотерапия, но пока там моего сообщения нет. Еще раз благодарю.
Регистрация: 13.06.2007 Сообщений: 93 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Я бы предположила, что это лучевой ожог.
У меня по-настоящему последствия лучевой начались уже дома, почти через неделю после выписки. так называемый «эффект накопления».
Поговорите с радиологами.
Регистрация: 05.08.2007 Сообщений: 0 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Спасибо за ответ. У мужа отек начался тоже через несколько дней после выписки. Но в данный момент я не могу проконсультироваться с радиологами, т.к. живем в Анапе, а лечение проходили в Ростовском НИ онкологическом институте. Ехать только в конце месяца. А у Вас отек долго держался и что Вы предпринимали?
Регистрация: 16.12.2005 Сообщений: 944 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Наталья Мошенская,
А вам врачи про компресы Димексидом не говорили? Я вот от ожёгов делала, помогла, и ещё метилурациловой мазью мазала, хотя говорят лучше есть.
Регистрация: 05.08.2007 Сообщений: 0 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Нет,о димексиде не говорили, Назначили Актовегин(мазь),олазоль и полоскания малавитом. Нас даже не предупредили о возможных осложнениях! Что уж там о препаратах говорить!
Регистрация: 20.04.2007 Сообщений: 347 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Лучевые реакции, как ранние, так и поздние (фиброз) бывают только в местах, подвергавшихся лучевому воздействию. При послеоперационной лучевой терапии лицо в зону облучения не попадает. Соответственно постлучевым фиброзом этот отек быть не может, не говоря и о том, что фиброз после облучения развивается только через несколько месяцев.Можно предположить, что отек связан с нарушением оттока лимфы. Причинами могут быть расширенная лимфодиссекция + лучевая терапия на зоны лимфоттока. Лечение — препараты улучшающие микроциркуляцию (детралекс, трентал).
Судить о чем то еще без осмотра пациента сложно
Регистрация: 13.06.2007 Сообщений: 93 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
На счет попадает или не попадает лицо в зону облучения. могло и попасть.
При мне женщине гортань облучали — к середине курса она уже ходила с красным и отекшим лицом.
Возможно, лимфоузлы облучались.
Регистрация: 16.12.2005 Сообщений: 944 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
fishka : А мне радиолог в свое время сказала — «да хоть золотом мажь — все это бесполезно», посоветовала только детский крем и присыпку. я лечилась спреем от ожогов с облепиховым маслом — и обезбаливает, и заживляет.
Странно, так как мне объясняли врачи по другому 
От ожогов именно на коже кстати некоторые Пантенолом мазались и вполне успешно, просто я была не в курсе что метилурациловая мазь прошлый век потому и мазалась)
Регистрация: 20.04.2007 Сообщений: 347 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Лучевой эпидермит и постлучевой фиброз абсолютно разные осложнения. Лучевой эпидермит связан с гибелью клеток росткового слоя кожи в процессе облучения. Соответственно лечение местное и направлено на подавление инфекции, обезболивание и стимуляцию роста клеток. Ваш радиолог в принципе права: остановить гибель клеток существенно пока не удается (достаточно эффективных радиопротекторов пока нет) , можем только создать условия для ускорения делениея и роста оставшихся в живых (кстати по золото.. может она что то другое имела ввиду ).
Совсем другая ситуация с фиброзом. Изменения связаны с повреждением сосудов в подкожной клетчатке и связанной с этим гипоксией. Фиброзная ткань при этом не истончается, а наоборот разрастается. При выраженном процессе начинает страдать и кровоснабжение эпидермиса. Соответственно лечение направлено на улучшение кровоснабжения, приостановку роста фиброзной ткани (антиоксиданты, димексид). Димексид — достаточно уникальный препарат, он хорошо проникает в ткани с низким уровнем кровоснабжения
Регистрация: 16.12.2005 Сообщений: 944 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Филимонов А.В.,
Дааа. я в шоке)))как так может быть что одно и тоже совершенно по разному объясняют. Спасибо Александр Вячеславович за просвещение!
Регистрация: 06.07.2007 Сообщений: 54 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
А избежать появления фиброза нельзя?Я в ужасе..Мне тоже предстоит облучение.
Регистрация: 20.04.2007 Сообщений: 347 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Не так страшен черт, как его малюют.
Толерантная доза для соединительной ткани — 60 Гр. Т.е., риск фиброза значительно возрастает при радикальных курсах, когда в подкожной клетчатке доза превышает этот уровень. При дозах порядка 30 — 40 Гр риск выраженного фиброза не так велик.
Если планируется радикальный курс, и особенно это касается опухолей внутренних органов, более выгодно лечение на линейных ускорителях. В отличие от кобальта, максимум дозы на этих аппаратах глубже подкожной клетчатки.
Регистрация: 05.08.2007 Сообщений: 0 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Спасибо большое всем, кто принимает участие в этой беседе!
Александр Вячеславович, как долго обычно длится этот период, во время которого человек испытывает болевые ощущения, последствия облучения( ожог, покраснения, волдыри)? Муж закончил облучение 20 июля. Во время облучения была припухлость, потом она поползла на лицо. 21 мы приехали домой в Анапу ( лечились в Ростове) и отек стал увеличиваться. В Ростове были у нейроонколога. Он поставил след.диагноз: невропатия ушно-височного нерва ( если я правильно поняла латынь). Рекомендовал финлепсин, мовалис, кетонал. Затем радиолог назначила мочегонные. После них отек немного спал. Дома я продолжила давать мужу диакарб с панангином. И еще невролог в Анапе рекомендовал нам эскузан. Один раз отек практически спал, но тут начало дико болеть ухо и отек полез снова.
Возможно стоит посоветоваться с неврологом по поводу детралекса или трентала? Ни в Ростовском НИИ, ни в Анапе нам ничего об этом не говорили. Спасибо Вам!
источник
Осложнения лучевой терапии при лечении злокачественных опухолей
Облучение онкологических больных сопряжено с достаточно высоким риском возникновения повреждений.
Это обстоятельство обусловлено наличием в облучаемом объеме так называемых «критических» органов и тканей, имеющих ограниченную толерантность; относительной радиорезистентностью большинства опухолей, что диктует необходимость подведения высоких поглощенных доз; и, наконец, сложностью осуществления в полном объеме требуемых профилактических мер.
Следовательно, возникновение лучевых повреждений различной степени выраженности является закономерным при проведении лучевого и комбинированного лечения.
Более того, полное отсутствие каких-либо реакций и осложнений в конкретном специализированном медицинском центре является не вполне благоприятным показателем, свидетельствующим о неполном использовании возможностей радикальной лучевой терапии.
Важно лишь то, чтобы их частота не превышала допустимого уровня в 5%, определенного международными рекомендациями и они не были тяжелыми, то есть не вызывали инвалидизацию или смерти пациента.
Радиобиологические основы возникновения лучевых повреждений
Для ясного представления о стоящих перед радиологом трудностях и методах их преодоления необходимо рассмотреть целый ряд аспектов, связанных с воздействием ионизирующего излучения на нормальные ткани организма.
В целом существующие типы нормальных тканей подразделяются на, так называемые иерархические, или Н-типа (по начальной букве соответствующего английского термина) и гибкие (flexible) или F-типа. Первые четко различаются по характеру клеток — стволовые, фракции роста и постмитотические зрелые клетки.
Процессы в них идут быстро и они ответственны в основном за ранние лучевые повреждения. Классическим примером являются гемопоэтическая система, слизистые оболочки, эпителий тонкой кишки.
Ткани гибкого типа состоят из однородной популяции функциональных клеток, существенно не различающихся по пролифератинной активности, процессы обновления в ни идут медленно. Они (почки, печень, центральная нервная система) отвечают в основном на облучение с развитием поздних повреждений.
Поэтому и сегодня справедливым остается закон И. Бергонье-Л.Трибондо (1906), согласно которому наибольшей радиочувствительностью обладают часто и быстро делящиеся, с большой продолжительностью (разы митоза, менее дифференцированные с низкой функциональная активность клетки.
Ранние лучевые реакции и повреждения
Если суммировать их особенности, то можно сказать следующее: они возникают во время курса облучения или спустя 3-9 недель и длительность латентного периода не зависит от агрессивности лечения; ранние повреждения в малой степени зависят от величины дозы за фракцию, а укорочение общего времени курса облучения ведет к возрастанию их частоты и степени тяжести. При этом они являются транзиторными и, как правило, быстро регрессируют, хотя могут служить предвестниками развития поздних повреждений.
Поздние лучевые повреждения возникают, в противоположность ранним, спустя три и более месяцев, обычно в интервале 0,5-5 лет. Для них характерны четкая корреляция с величиной поглощенной дозы за фракцию, а общее время лечения не является существенным.
Ранние реакции могут быть общими и местными, поздние — чаще местными. Поздние повреждения являются необратимыми и хотя могут развиваться компенсаторные механизмы, необходима реабилитация таких больных или специальное лечение.
Общие принципы профилактики лучевых повреждений
Следует всегда помнить, что первоочередная задача радиолога — профилактика поздних лучевых повреждений, которые могут быть более тягостными, чем основное онкологическое заболевание (например, ректовагинальные и ректовезикальные свищи, остеорадионекроз, поперечный миелит и др.).
С радиобиологических позиций необходимо осуществлять целый комплекс мероприятий, которые включают в себя рациональный выбор дозы и ее распределения во времени, использование радиомодификаторов (сенсибилизаторов и протекторов), а также разработку обоснованных схем химиолучевого лечения с учетом фазоспецифичности препаратов. По всем этим направлениям ведутся активные исследования.
Прежде всего, важно помнить, что стандартные значения толерантных поглощенных доз для различных органов и тканей являются весьма приблизительным ориентиром при планировании лучевой терапии (табл. 9.3).
Таблица 9.3. Толерантные дозы гамма-излучения для различных органов и тканей при фракционировании дозы по 2 Гр 5 раз в неделю [Бардычев М.С., 1996].
Необходимо также учитывать индивидуальный ответ облученных тканей, который может в некоторых случаях различаться в десятки раз. Без преувеличения можно назвать искусством подведение необходимых туморицидных доз с максимальным щажением нормальных органов и тканей.
Для профилактики ранних реакций оправданно применение нетрадиционных режимов ускоренного, динамического и гиперфракционированного облучения, а также их комбинаций. Сокращение общего времени лечения, особенно на первом этапе, позволяет добиться быстрого регресса опухоли и уменьшить число местных лучевых повреждений.
Вместе с тем дневное дробление дозы позволяет, не снижая туморицидного действия, осуществить профилактику поздних повреждений нормальных тканей. Помимо этого, многоцелевая профилактика лучевых повреждений должна включать в себя рациональное пространственное планирование, выбор обоснованных дозовременных соотношений, а также местное и системное терапевтическое воздействие.
Tак, применение дистанционного и локального воздействия оправдано при высокодифференцированных новообразованиях с преимущественной склонностью к местному распространению. Считается, что суммарные дозы свыше 90 Гр могут приводить к возрастанию частоты повреждений.
Однако появление методик конформной лучевой терапии и повышение точности укладок пациентов позволило, например, при локальной форме рака простаты дистанционно подводить до 120 Гр.
Классификация лучевых повреждений
Совершенствование методик облучения невозможно без тщательного и корректного анализа возникающих при этом лучевых реакций и осложнений со стороны нормальных органов и тканей.
Это особенно важно в плане повышения эффективности лечения, что ведет к увеличению выживаемости и, соответственно, возрастанию числа поздних осложнений. Вместе с тем до недавнего времени в вопросах классификации лучевых повреждений практически отсутствовало единообразие подходов.
В настоящее время наиболее признанной является классификация, разработанная Радиотерапевтической онкологической группой совместно с Европейской организацией по исследованию и лечению рака (RTOG/EORC, 1995). Она построена с учетом различий клинических проявлений ранних и поздних лучевых повреждений, границей между которыми является срок около 90-100 дней (3 месяца).
При этом поздние лучевые повреждения могут быть бинарными, т.е. реакция тканей происходит по типу «да-нет», градационными (имеют различную степень выраженности) и непрерывными. Классическими примерами бинарного поражения является радиационный миелит, градационного — телеангиоэктазии и фиброз подкожной клетчатки, непрерывного — рентгенологические проявления легочного фиброза.
Все повреждения по степени тяжести проявлений оцениваются по пятибальной шкале (от 0 до 5), при этом символу «0» соответствует отсутствие изменений, а «5» — смерть пациента в результате лучевого повреждения. Ниже приводятся наиболее типичные побочные реакции и осложнения.
Общая лучевая реакция
Общая реакция организма на облучение может проявляться разнообразными клиническими симптомами, в основе которых лежат функциональные нарушения нервной, эндокринной, сердечно-сосудистой и кроветворной систем. Лучевое лечение может сопровождаться нарушением сил, носом, одышкой, тахикардией, аритмией, болями в сердце, гипотонией, а также лейкопенией и тромбоцитопенией.
Вегето-сосудистые реакции, как правило, самостоятельно проходят в течение 2-4 нед, иногда могут потребовать симптоматической коррекции и редко — прекращения лучевой терапии. При необходимости назначают коррегирующую терапию: антигистаминные препараты, транквилизаторы, иммуномодуляторы, дезинтоксикационную терапию. Эффективен антиоксидантный комплекс (витамины А, Е и С).
Местные лучевые повреждения
Основной проблемой лучевой терапии является возможное повреждение окружающих опухоль здоровых тканей с развитием характерной картины местного (в области поля облучения) лучевого поражения. Как известно, оптимальность дозы облучения при лучевой терапии определяется величиной, достаточной для эрадикации всех опухолевых клеток без грубых повреждений окружающих нормальных тканей.
Максимальную безопасную дозу облучения части или всего объема ткани принято называть толерантной. Чем в меньшей степени суммарная поглощенная доза излучения превышает толерантность облучаемых тканей, тем реже наблюдаются местные лучевые повреждения (табл. 9.3).
Лучевые реакции в зоне облучения делят на ранние и поздние, а также отдаленные генетические последствия. К ранним местным относят лучевые повреждения, развивающиеся в процессе лучевой терапии или в ближайшие 3 мес после нее (крайний срок восстановления сублетально поврежденных клеток).
Поздними считают местные лучевые повреждения, развившиеся после указанного срока, часто через много лет. Отдаленные генетические последствия могут наблюдаться при воздействии излучений на гонады.
Патогенез местных лучевых повреждений
Подразделение местных лучевых повреждений на ранние и поздние важно потому, что их патогенетические механизмы возникновения и методы лечения различны.
Ранние местные лучевые повреждения.
В генезе ранних лучевых повреждений наряду с воздействием на генетический аппарат клетки, снижением репаративных процессов и гибелью облученных клеток основными являются функциональные расстройства, в первую очередь нарушения кровообращения.
Наиболее частой причиной развития ранних повреждений являются высокие суммарные дозы излучения, значительно превышающие толерантность облучаемых тканей, или их повышенная радиочувствительность.
Поздние местные лучевые повреждения
В основе их развития лежит повреждение кровеносных и лимфатических сосудов и интерстициальное пропитывание тканей белком. При применении толерантных или близких к ним доз излучения происходит повреждение капиллярного русла, вначале функционального (спазм, стаз), а затем — морфологического (фиброз) характера, что приводит к повышению давления в капиллярах и выходу белков в ткани, а также нарушению процессов микроциркуляции.
При этом часть крови, минуя капилляры, переходит из артериального русла в венозное. В результате раскрытия артериовенозных шунтов явления гипоксии в тканях нарастают и, как следствие, происходит усиление склеротических процессов. Выраженные ишемия и фиброз в облученных тканях в свою очередь вызывают еще большее усиление гипоксии, т.е. образуется порочный круг.
При сходстве патогенетической картины развития поздних местных лучевых повреждений их клиническое течение характеризуются значительным разнообразием. Общим является наличие латентного периода и прогрессирование возникших морфологических изменений облученных тканей (например, поздний лучевой дерматит со временем часто переходит в лучевую язву).
Поздние лучевые повреждения, в отличие от ранних, никогда полностью не излечиваются. Тенденция к прогрессированию возникших морфологических изменений облученных тканей является основой превентивного подхода к лечению местных лучевых повреждений (возможно раннего и возможно радикального).
Лечение местных лучевых повреждений — это длительный процесс требующий большого внимания, терпения и настойчивости. Ниже приводятся наиболее часто встречающиеся проявления местных лучевых повреждений и принципы их лечения.
Местные лучевые повреждения и принципы лечения
Ранние лучевые повреждения характеризуются выраженной болью и жжением в зоне поражения. По своему проявлению они во многом напоминают ожог, поэтому иногда их называют лучевым ожогом (лучевым эпителиитом), диагностика которого не представляет трудностей.
Тяжесть повреждения может быть от сухого дерматита до раннего лучевого некроза. Лечение ранних лучевых реакций и повреждений в основном симптоматическое и направлено на уменьшение чувства жжения и стягивания в зоне облучения.
Обычно такие повреждения через 2-4 нед самопроизвольно проходят, лишь у лиц с повышенной чувствительностью требуется проведение специального лечения. При лечении эритемы, сухого или влажного эпидермита наиболее эффективны аппликации в виде повязок с 10% р-ром димексида 1-2 раза в день до высыхания.
Затем область поражения смазывают каким-либо маслом: свежим сливочным, прокипяченым оливковым (подсолнечным), маслом шиповника, облепихи и т.п. С целью уменьшения болей и жжения применяют также местноанестезирующие мази (с анестезином, новокаином и др.). Эффективны мази «Левосин», «Левомеколь», «Ируксоп», «Олазол».
При наличии выраженной воспалительной реакции показаны мази с кортикостероидными гормонами. Шесть факторов способствуют улучшению условий заживления: влажность кожных покровов, оксигенация, чистота, кислая рН, отсутствие местных и общих вредных воздействий.
Выбор медикаментозных средств при лечении ранних лучевых язв проводят с учетом фазности течения раневого процесса. При выраженных некробиотических процессах с экссудативно-гнойным отделяемым следует применять лишь антисептические растворы и растворы протеопитических ферментов.
По мере стихания воспалительного процесса, очищения язвы и появления грануляционной ткани переходят на мазевые композиции. При поверхностных изъязвлениях перечисленных консервативных мероприятий оказывается достаточно и в течение 4-6 нед язвы рубцуются. При ранних лучевых язвах, развившихся после гамма-терапии, как правило, требуется хирургическое лечение.
Поздние лучевые повреждения кожи проявляются в виде атрофического или гипертрофического дерматита на фоне ангиотелеэктазий, строго повторяющих форму полей облучения. Тяжесть позднего лучевого повреждения кожи может нарастать от лучевого атрофического дерматита к поздней лучевой язве. Обычно наиболее мучителен для больных период формирования лучевой язвы, который сопровождается выраженной болью.
Развитие лучевой язвы кожи при лучевой терапии опухолей внутренних органов легко диагностируют. Однако когда образуется язва после лучевой терапии злокачественной опухоли кожи (рак, меланома) возникают затруднения при дифференциальной диагностике, которые разрешаются гистологическим исследованием биоптата.
Лечение поздних лучевых повреждений кожи проводят с учетом клинической формы повреждения. При атрофическом дерматите рекомендуется применять глюкокортикоидные мази и витаминизированные масла. Хороший терапевтический эффект при лечении гипертрофического дерматита и лучевого фиброза оказывает рассасывающая терапия в виде электрофореза димексида, протеопитических ферментов и гепарина.
Лечение начинают с электрофореза 10% водного р-ра димексида (20 мин ежедневно, 10-15 процедур), чем достигают уменьшения отека и воспалительной реакции тканей, размягчения зоны лучевого фиброза за счет резорбции отдельных коллагеновых волокон.
В последующие дни на эту область проводят электрофорез протеолитических ферментов (трипсин, химопсин и др.) — 20 мин (ежедневно. 10-15 процедур), что приводит к уменьшению воспаления и отека. В заключение проводят электрофорез гепарина (5-10 процедур), который в сочетании с предыдущими процедурами улучшает микроциркуляцию, уменьшает гипоксию тканей и стимулирует репаративные процессы.
При лечении поздних лучевых язв в начальной стадии их формирования при выраженной экссудации применяют антисептические растворы — 10% димексида, 0,5% хлорамина, 1% перекиси водорода и т.п. По мере очищения язвы и появления грануляций применяются мазевые композиции: 10% мазь димексида, глюкокортикоидные мази, 10% мазь метилурацила и т.п.
Однако основной метод лечении поздних лученых повреждении кожи — радикальное иссечение поврежденных тканей с кожно-пластическим замещением дефекта.
Хирургическое лечение рекомендуется выполнять не только при лучевых язвах, но и при выраженных лучевых фиброзах, что позволяет предотвратить развитие серьезных осложнений в последующем <сепсис, профузные кровотечения, малигнизация).
Слизистые оболочки
Лучевые реакции слизистых оболочек (мукозиты, лучевые эпителииты) развиваются при облучении полых органов (гортань, полость рта, пищевод, кишечник, мочевой пузырь и др.). Радиочувствительность слизистых оболочек зависит от гистологического строения.
Клиническая картина лучевого эпителиита конкретных органов изложена ниже. Диагностируют лучевые повреждения слизистых оболочек желудочно-кишечного тракта, половых органов и органов мочеотделения на основании клинических проявлений и результатов эндоскопического исследования.
Подходы к лечению лучевых эпителиитов в целом однотипны и направлены на ликвидацию местных и общих реакций организма. Для лечения острых лучевых эпителиитов применяют орошение 5-10% р-ром димексида в виде полосканий при поражении слизистой оболочки полости рта или носоглотки (5-8 раз в день), микроклизм при лучевых ректитах или инсталляций в мочевой пузырь (2 раза в сутки) при лучевых циститах.
Такое лечение чередуется со смазыванием слизистой оболочки масляными композициями (облепиховое масло, масло шиповника). При лечении эпителиита верхних дыхательных путей проводят ингаляции 5-10% р-ра димексида с антибиотиками, рекомендуют прием перед едой свежего сливочного масла, 30% масла облепихи или оливкового (подсолнечного) масла.
Такое же лечение назначают и при лучевом эзофагите. Наряду с местным лечением назначают антигистаминные препараты, транквилизаторы, иммуномодуляторы, по показаниям — коррекция свертывающей системы и гемодинамики. Для стимуляции эпителизации — солкосерил местно в виде желе или мази и внутримышечно.
Слюнные железы
При лучевой терапии опухолей верхней и нижней челюсти, твердого и мягкого неба, дна полости рта, языка наряду с радиоэпителиитом наблюдаются нарушение слюноотделения и изменение вкусовых ощущений.
Ксеростомия — нарушение функции слюнных желез — проявляется в виде сухости во рту и отделением густой слюны в течение дня. Слюноотделение нормализуется через 2-4 нед, вкусовые ощущения — через 3-5 нед по окончании лучевой терапии. Лечение — симптоматическое.
Гортань
Легкое
Лучевые изменения в легочной ткани начинаются с функциональных нарушений (застой в малом круге кровообращения, отек слизистой оболочки бронхов, дисковидные ателектазы). В основе этих изменений лежит нарушение проницаемости сосудов с последующим отеком, кровоизлияниями, стазом, экссудацией.
Затем развивается пульмонит — первая и основная реакция легочной ткани на ее облучение. Характеризуется кашлем, одышкой, болями в груди и гипертермией до 38°С. На рентгенограммах отмечаются усиление корневого и легочного рисунка, массивные инфильтраты, а иногда и массивный долевой или субдолевой отек.
Лечение ранних лучевых повреждений легких включает противовоспалительную терапию и превентивное лечение пневмосклероза. Лечение заключается в массивной, с учетом результатов исследования флоры мокроты, антибиотикотерапии, назначении нестероидных противовоспалительных препаратов, применении бронхо- и мукопитиков, антикоагулянтов, постоянной ингаляции кислорода.
В основе поздних лучевых повреждений легких лежит фиброзно-склеротический процесс различной степени выраженности. Характерным их признаком является несоответствие скудных клинических симптомов и обширных рентгенологически выявляемых изменений в легких.
Наиболее эффективное средство лечения поздних лучевых повреждений легких — ингаляции димексида Лечение начинают с ингаляции 5% смеси димексида с преднизолоном из расчета 30 мг последнего на 50 мп раствора димексида. После 2-3 ингаляций при хорошей переносимости концентрацию димексида увеличивают до 10-20%. На курс лечения 15-25 ингаляций.
Сердце
Лучевые повреждения сердца развиваются через несколько месяцев или даже лет после окончания лучевого лечения и проявляются лучевым перикардитом. Симптомы его аналогичны перикардиту любой этиологии (появление температуры, тахикардия, шум трения перикарда).
Клиническое течение лучевого перикардита варьирует от ограниченного процесса до слипчивого перикардита. Поражение миокарда на ЭКГ выявляется в виде сглаживания зубца Т, подъема интервалов ST и снижения комплекса QRS.
Лечение лучевых повреждений сердца в основном симптоматическое. При лучевых экссудативных перикардитах улучшение дает пункция перикарда с эвакуацией жидкости и последующим введением кортикостероидов, при констриктивных — хирургическое лечение в виде фенестрации перикарда и выделении магистральных сосудов из спаек.
Пищевод
Кишечник
При лучевой терапии органов брюшной полости и таза в зону облучения всегда попадает кишечник. При облучении кишечника в дозах, превышающих толерантность, возникают повреждения его стенки в виде лучевого ректита, ректосигмоидита и энтероколита с различной степенью местных изменений вплоть до некроза.
Наиболее тяжелыми являются некрозы и инфильтративно-язвенные процессы, особенно при повреждении тонкой кишки. Лучевой мукозит характеризуется существенными изменениями кровеносных сосудов. В ранние сроки наблюдается выраженная гиперемия легко ранимой слизистой оболочки (катаральная форма).
При эрозивно-язвенной форме лучевого мукоэита кишечника наблюдаются поверхностная деструкция слизистой оболочки (эрозия) или глубжележащих слоев стенки кишки с подрытыми или твердыми краями (язва).
При поздних лучевых ректитах и ректосигмоидитах жалобы больных сводятся к наличию постоянного дискомфорта, усиливающегося при дефекации, неустойчивого стула с чередованием запоров и поносов с примесью слизи и крови в кале. Могут быть кровотечения, вплоть до профузных.
При эндоскопии на фоне атрофии слизистой оболочки выявляются отдельные значительно расширенные кровеносные сосуды (ангиотелеэктазии), нарушение целости которых и приводит к перемежающимся обильным кровотечениям из прямой кишки.
У больных с ранними и поздними лучевыми повреждениями кишечника значительно страдает его абсорбционная функция (особенно при лучевом энтероколите) с нарушением всасывания и усвоения белков, липидов, витаминов, железа (даже при показателях гемоглобина, близких к нормальным). Для восстановления абсорбционной функции кишечника необходимо проводить соответствующее лечение.
Лечение больных с лучевыми повреждениями кишечника должно быть комплексным, местного и общего действия. Местное лечение лучевых повреждений кишечника направлено на снижение воспаления и стимуляцию репаративных процессов. Наилучшие результаты получены при последовательном выполнении следующей схемы лечения.
В течение 1-й недели назначают очистительные клизмы с теплым раствором отвара ромашки. При значительном количестве крови в кале отвар ромашки чередуют с микроклизмами 0,5% р-ра перекиси водорода или 5% р-ра аминокапроновой кислоты. В течение последующих 2-3 нед в толстую кишку с учетом уровня лучевого повреждения вводят по 50-75 мл 5% р-ра димексида с 30 мг преднизолона (2 раза в сутки).
В последующие 2-3 нед назначают масляные микроклизмы (10% мазь метилурацила, масло шиповника или облепихи, рыбий жир, оливковое или подсолнечное масло). При выраженном половом синдроме одновременно назначают смесь метирацила с новокаином, анестезином и преднизолоном.
При наличии ректовагинальных или ректовезикапьных свищей диаметром до 1 см такое лечение в течение 6-12 мес у большинства больных приводит к их закрытию. При свищах диаметром более 2 см следует своевременно формировать холостому для предотвращения развития уросепсиса и улучшения качества жизни больных.
При развитии лучевых стенозов облученных сегментов тонкой или толстой кишки, как исхода поздних лучевых повреждений, проводятся соответствующие оперативные вмешательства.
Почки
Мочевой пузырь
Лучевые циститы (катаральные, эрозивно-десквамативные и язвенные) проявляются частыми позывами на мочеиспускание, макрогематурией, резью по ходу уретры, болями в области мочевого пузыря. При лечении лучевых циститов основное внимание следует уделять интенсивной противовоспалительной терапии и стимуляции репаративных процессов.
Противовоспалительное лечение включает назначение уроантибиотиков (невиграмон, папин, гентамицин). Эффективны инсталляции в мочевой пузырь антисептиков (р-ры протеопитических ферментов, 5% р-р димексида) и средств, стимулирующих репаративные процессы (10% р-р дибунола или метилурацила).
К поздним лучевым повреждениям, являющимся, как правило, исходом ранних повреждении, относятся атрофический лучевой цистит, рубцовый стеноз мочеточников, поздняя лучевая язва пузыря, возможно развитие радиоиндуцированного рака.
Лечение поздних лучевых повреждений мочевого пузыря состоит в применении препаратов, стимулирующих репаративные процессы (метилурацил, дибунол, глюкокортикоиды, димексид). С целью предотвращения лучевого стеноза мочеточников показана превентивная рассасывающая терапия, важным компонентом которой является 10% димексид в сочетании с глюкокортикостероидами в виде микроклизм ежедневно в течение 30-40 дней.
Стеноз мочеточников является показанием к их антеградному бужированию. При нарастании гидронефроза и угрозе уремии показаны более радикальные корригирующие операции (стентирование, нефростомия, уретерокутанеостомия или нефрэктомия).
Кровеносные и лимфатические сосуды
Выраженные лучевые повреждения магистральных кровеносных и лимфатических сосудов ведут к нарушениям регионарной циркуляции дистальнее зон облучения и клинически проявляются развитием отека соответственно верхней или нижней конечности. Чаще всего такие зоны повреждения локализуются в подмышечных или пахово-подвздошных областях.
Диагностика их не вызывает больших трудностей. Наличие позднего дерматофиброза в указанных областях, ангиолимфография позволяет уточнить диагноз и исключить возможность опухолевой компрессии магистральных сосудов при прогрессировании злокачественного процесса. Лучевой лимфостаз и слоновость конечностей чаще всего развиваются в результате сочетания облучения регионарных лимфатических коллекторов с лимфаденэктомией.
При венозном или артериальном нарушении оттока крови методом выбора является консервативное лечение. Лечение же лучевых лимфостазов должно быть превентивным. Развитие слоновости предотвращает своевременное восстановление путей лимфооттока посредством микрохирургического лимфовенозного шунтирования (на нижних конечностях — анастомоз между дистальной половиной лимфатического узла и подкожной веной, на верхней — анастомоз лимфатического сосуда с веной).
При неэффективности консевативного лечения применяются паллиативное (модификации операции Кондолеона, заключающиеся в частичной резекции кожи и фиброзно-измененной подкожной жировой клетчатки с фасцией) или «радикальное» хирургическое вмешательство (тотальное иссечение всех фиброэно-измененных тканей с кожной пластикой).
Особую проблему составляют поздние лучевые повреждения у детей, которые проявляются в виде косметических и функциональных дефектов в различных органах и тканях. Даже небольшие дозы излучений высоких энергий, подведенные к растущей кости, могут вызвать подавление ее роста, что в последующем может проявиться в искривлении позвоночника (кифоз, лордоз, сколиоз), хромоте (после облучения тазовой области).
При облучении головного мозга у детей до завершения миелинизации и полного его развития возникает дисфункция и недоразвитие мозга вследствие гибели капилляров с исходом в микрообызвествления. При облучении спинного мозга, как проявление ранней лучевой реакции, наблюдается синдром Лермитта (парастезии, вызывающие напряжение позвоночника), который без каких-либо последствий купируется самостоятельно в течение нескольких недель.
Поздние лучевые реакции проявляются лучевым миелитом с парестезиями. нарушением поверхностной и глубокой чувствительности. Облучение зоны молочных желез приводит к их недоразвитию, мышц — к атрофии.
Генетические последствия лучевой терапии
Влияние облучения будущих родителей на возможность развития опухолей у их потомков изучено мало и касается проблемы возможных генетических эффектов излучений на гонады. Гонадные клетки обладают высокой радиочувствительностью, особенно в первые годы жизни.
Известно, что однократная поглощенная доза 0,15 Гр может вызывать у взрослого мужчины резкое сокращение количества спермы, а увеличение ее до 12-15 Гр — полную стерильность. Экспериментальные исследования подтверждают наследственную природу радиационных опухолей.
Показано, что облучение индуцирует в ДНК сперматозоидов (яйцеклетки) мутации, ведущие к развитию новообразований у потомства. Поэтому необходимо искать эффективные пути защиты гонад, особенно при проведении лучевой терапии детям.
В частности, при необходимости облучения тазовой области предварительно проводится оперативное перемещение яичников из зоны прямого лучевого воздействия, что сохраняет их функцию и не нарушает в дальнейшем возможности деторождения.
Радиоиндуцированный канцерогенез
Уже спустя несколько лет после открытия рентгеновского излучения были отмечены случаи индуцированного рентгеновским облучением рака кожи. Позднее было установлено, что риск развития рака возрастает при дозах до нескольких грей, а при более высоких — уменьшается, что, видимо, связано с гибелью клеток под действием излучения, а не их мутагенным повреждением (при малых дозах).
Между тем международной комиссией по радиационной защите принята рабочая гипотеза о том, что нет дозы, даже малой, которая не была бы сопряжена с риском развития злокачественной опухоли (беспороговая концепция).
Считается, что индукция второго первичного рака большей частью происходит в облученных тканях, хотя и составляет, видимо, менее 0,1% случаев. Латентный период или период индукции для большинства опухолей превышает 30 лет и сильно варьирует. Из всех новообразований раньше всего проявляется лейкемия (чаще всего через 3-7 лет).
Кроме рака кожи, описаны случаи индуцированного рака щитовидной железы, легкого, поджелудочной железы, опухолей соединительной ткани и костей. Проблема радиоиндуцированного канцерогенеза особенно актуальна в детской онкологии.
В настоящее время 60-70% детей, перенесших злокачественные опухолевые заболевания, живут длительное время и у них к 20-летнему возрасту риск повторного возникновения злокачественных опухолей достигает 12%.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
источник



